Eine Gruppe um CUI-Forscher Prof. Henry Chapman hat eine neue Möglichkeiten für die Analyse empfindlicher Biomoleküle mittels Synchrotronstrahlung getestet. Der neuartige Ansatz, den die Wissenschaftlerinnen und Wissenschaftler vom Hamburger Center for Free-Electron Laser Science CFEL im wissenschaftlichen Fachjournal „IUCrJ“ der Internationalen Union für Kristallographie vorstellten, ist ursprünglich für Untersuchungen mit Röntgenlasern entwickelt worden. Die Methode kann nun die atomare Struktur von Proteinen enthüllen, die sich mit sogenannten Synchrotronstrahlungsquellen wie PETRA III bislang nicht analysieren ließen.
Die atomare Struktur von Proteinen kann Forschern etwas über die Funktionsmechanismen dieser Biomoleküle verraten. Das liefert nicht nur neue Einblicke in die Biologie, sondern oft auch die Grundlage für die Entwicklung neuer, maßgeschneiderter Medikamente. Das Universalwerkzeug zur Analyse der atomaren Struktur von Proteinen ist die Röntgenkristallographie, bei der ein Proteinkristall mit einem hellen Röntgenstrahl durchleuchtet wird. Der Kristall beugt das Röntgenlicht auf charakteristische Weise und erzeugt damit ein sogenanntes Streubild, aus dem sich die innere Struktur des Kristalls und damit die atomare Struktur des Proteins berechnen lässt.
„Für die meisten Biomoleküle ist es allerdings ein unnatürlicher Zustand, in einen Kristall gezwängt zu werden. Daher bilden viele Proteine nur winzige Kristalle. Je kleiner ein Kristall ist, desto heller muss das Röntgenlicht sein, um brauchbare Streubilder zu erzeugen“, erläutert Prof. Chapman. Mit sogenannten Freie-Elektronen-Lasern (FEL), große Anlagen, die von einem Teilchenbeschleuniger gespeist werden, lassen sich noch Kristalle analysieren, die weniger als einen tausendstel Millimeter (Mikrometer) Durchmesser haben. Der helle Röntgenblitz aus einem FEL verdampft allerdings den Kristall beim ersten Schnappschuss. Daher werden in der sogenannten Serien-Kristallographie mehrere zehntausend Mikrokristalle in schneller Folge nacheinander durchleuchtet und die Streubilder anschließend in leistungsstarken Computern sortiert und kombiniert.
Synchrotronstrahlungsquellen können dagegen die atomare Struktur aus einem einzigen Kristall gewinnen, der allerdings groß genug und von sehr hoher Qualität sein muss. Während der Untersuchung wird der Kristall im Röntgenstrahl gedreht und so von allen Seiten untersucht. „Wir haben am Röntgenlaser beobachtet, dass einige Proben so groß waren und so gute Streubilder produziert haben, dass wir manchmal sogar den Strahl abschwächen mussten, um den Detektor nicht zu beschädigen“, berichtet Hauptautor Dr. Francesco Stellato von CFEL, einer Gemeinschaftseinrichtung von DESY, der Universität Hamburg und der Max-Planck-Gesellschaft. „Die FEL-Methode der Serien-Kristallographie könnte daher an einem hellen Synchrotron eine Lücke schließen für Proben, die zu klein sind für die konventionelle Synchrotronuntersuchung, aber im Prinzip zu groß für Freie-Elektronen-Laser.“
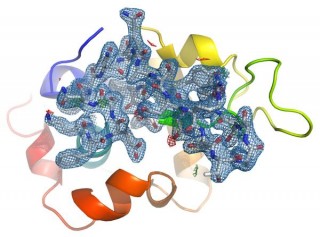
Elektronendichtekarte von Lysozym bei einer Auflösung von 2,1 Ångström, errechnet aus 40 233 Streubildern einzelner Kristalle.
Um diese Hypothese zu überprüfen, nutzten die Wissenschaftler das gut untersuchte Protein Lysozym aus dem Hühnereiweiß und züchteten dafür mikrometergroße Kristalle. An der zurzeit weltweit brillantesten Synchrotronstrahlungsquelle PETRA III zeichneten sie Serienschnappschüsse tausender dieser kleinen Lysozymkristalle im FEL-Stil auf und kombinierten die Messergebnisse. „Wir haben einen feinen Strahl mit Mikrokristallen durch den Röntgenstrahl fließen lassen und Serienaufnahmen gemacht, so schnell wie es mit dem Detektor möglich war“, erläutert CFEL-Forscher Dr. Dominik Oberthür aus dem Team.
Die Lysozymkristalle wurden als Suspension in wässriger durch eine dünne Kapillare quer durch den neun Mikrometer feinen Röntgenstrahl geleitet. Diese Technik funktioniert bei Raumtemperatur, und auf die sonst oft übliche Tiefkühlung der Proteinkristalle mit flüssigem Stickstoff konnte verzichtet werden. Die Fließgeschwindigkeit stellten die Forscher so ein, dass die einzelnen Mikrokristalle während ihrer kurzen Passage durch den energiereichen Röntgenstrahl keine nennenswerten Strahlenschäden erlitten. Die einzelnen Kristalle durchquerten den Röntgenstrahl in einer bis drei Millisekunden.
„Wir haben den Detektor auf Dauerfeuer gestellt und 25 Bilder pro Sekunde aufgenommen“, sagt Ko-Autor Dr. Alke Meents, Leiter der Messstation P11, an der die Experimente stattfanden. In den rund 17 Stunden Messzeit zeichneten die Wissenschaftler mehr als 1,5 Millionen Detektorbilder auf, aus denen ein Computer 40 233 brauchbare Streubilder herausfilterte. Aus diesen wiederum berechneten die Forscher die Lysozym-Struktur mit einer Genauigkeit von 2,1 Ångström, das sind 0,2 millionstel Millimeter. Die so berechnete Struktur stimmt ausgezeichnet mit der bekannten Lysozym-Struktur überein.
„Mit den geplanten Verbesserungen der Intensität der Röntgenstrahlung und durch Verwendung neuester Detektoren werden sich Bilder noch schneller aufzeichnen lassen und gleichzeitig die räumliche Auflösung verbessern“, erläutert Meents. „Auf diese Weise ebnet unsere Arbeit den Weg für die Strukturanalyse solcher Biomoleküle, die mit Synchrotronen bislang nicht untersuchbar sind.“
Originalarbeit:
“Room-temperature macrmolecular serial crystallography using synchrotron radiation”; Francesco Stellato et al.; IUCrJ, 2014; DOI: 10.1107/S2052252514010070

