Bakterielle Infektionserreger haben ausgefeilte Mechanismen entwickelt, um das Immunsystem des Menschen so zu entwaffnen, dass sie sich weitgehend ungehindert im Körper ausbreiten können. Einem Team um CUI-Prof. Martin Aepfelbacher vom Universitätsklinikum Hamburg-Eppendorf ist es in Kollaboration mit den Gruppen um CUI-Prof. Christian Betzel (Universität Hamburg) und Dmitri Svergun (Europäisches Laboratorium für Molekularbiologie in Hamburg) gelungen, wichtige Mechanismen einer bakteriellen Infektionsstrategie zu entschlüsseln. In der aktuellen Ausgabe der Fachzeitschrift PLOS Pathogens berichten die Forscher über ihre Entdeckung, die sowohl für Immuntherapien als auch für die Behandlung von Infektionen von Bedeutung sein könnte.
Yersinien, zu denen der Erreger der Beulenpest Yersinia pestis gehört, verfügen über eine besonders wirksame Infektionsstrategie: Ihnen gelingt es sogar, eines ihrer eigenen Proteine in den Zellkern einzuschleusen. Dort kann das YopM genannte Protein direkt die Expression von Genen stimulieren, die das Immunsystem abschalten, und somit immunsuppressiv wirken. „Die genauen Mechanismen, wie YopM zwischen dem Zytoplasma der Zelle und dem Zellkern pendelt, waren bisher unbekannt“, sagt der CUI-Wissenschaftler PD Dr. Markus Perbandt, ein Koautor der Studie. Das Team hat ein Protein entdeckt, das YopM aus dem Zellkern transportiert, und konnte dann zeigen, dass der so ermöglichte Pendelverkehr die Menge von YopM im Zellkern exakt einstellt. Außerdem gelang es den Forschern nachzuweisen, dass die Menge von YopM im Zellkern mit der Stärke seines immunsuppressiven Effekts korreliert. Aepfelbacher: „Der identifizierte Kernexportmechanismus kontrolliert also die Wirkung von YopM und somit den Erfolg der Bakterien, eine Infektion auszulösen.“
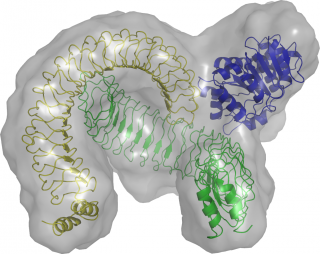
Die Struktur des YopM/DDX3 Komplexes wurde mittels Röntgenkleinwinkelbeugung und Röntgenkristallographie bestimmt. © PLOS Pathogen
Das Protein, das dabei hilft YopM aus dem Zellkern zu transportieren, heißt DDX3 und ist eine sogenannte DEAD-box RNA Helicase. DDX3 wird selbst über ein drittes Protein namens CRM1 aus dem Zellkern transportiert. In Kollaboration mit den Gruppen um Christian Betzel und Dmitri Svergun gelang es, eine Isoform von YopM zu kristallisieren und dessen Struktur zu lösen. Auf dieser Basis konnten die Wissenschaftler die Struktur des Komplexes aus YopM und DDX3 mittels Röntgenkleinwinkelbeugung (SAXS) aufklären. Dabei zeigte sich, dass YopM ein Dimer bildet und die N-terminale Domäne von DDX3 (Domäne 1) an eine Interaktionsstelle der beiden Monomere bindet. In einer früheren Studie wurde bereits beschrieben, dass der Exportfaktor CRM1 an die C-terminale Domäne von DDX3 (Domäne 2) bindet.
Mit dieser neuen Datenlage erstellten die Forscher schließlich ein hypothetisches Modell eines Kernexportkomplexes mit dem bakteriellen YopM, DDX3 und dem Exportprotein CRM1. „Diese Entdeckungen haben mehrere Implikationen“, erläutert Aepfelbacher „Das Wissen über seine genaue Wirkweise könnte YopM einerseits als therapeutisches Agens – wenn z.B. ein immunsuppressiver Effekt gewünscht ist – interessant machen. Andererseits könnten neue Hemmstoffe gegen YopM zur Behandlung von Yersinieninfektionen geprüft werden.“
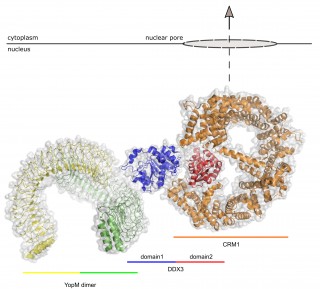
Hypothetisches Modell des Kern-Export-Komplexes bestehend aus YopM, DDX3 und CRM1. Es basiert auf experimentell bestimmten Proteinstrukturen und Interaktionsstellen zwischen den Proteinen. © Martin Aepfelbacher
Originalpublikation:
Berneking L, Schnapp M, Rumm A, Trasak C, Ruckdeschel K, Alawi M, Grundhoff A, Kikhney AG, Koch-Nolte F, Buck F, Perbandt M, Betzel C, Svergun DI, Hentschke M, Aepfelbacher M.
„Immunosuppressive Yersinia Effector YopM Binds DEAD Box Helicase DDX3 to Control Ribosomal S6 Kinase in the Nucleus of Host Cells“
PLoS Pathog. 2016 Jun 14;12(6):e1005660
DOI: 10.1371/journal.ppat.1005660

