Sogenannte Vitamin-Transporter sind dafür verantwortlich, dass Bakterien unverzichtbare Nährstoffe aufnehmen können. Ein Forscherteam unter der Leitung von CUI-Mitglied Prof. Henning Tidow (Universität Hamburg) hat die Struktur eines Thiamin-Transportproteins entschlüsselt – ein wichtiger Meilenstein für die Forschung zu Transportvorgängen an Membranen und damit langfristig für die Entwicklung von Medikamenten. In der aktuellen Ausgabe des Fachmagazins Cell Chemical Biology berichten die Wissenschaftler über ihre Ergebnisse; eine Visualisierung ihrer Ergebnisse ist auf dem Magazin-Cover zu sehen.

Es wird angenommen, dass ECF-Transporter mit Hilfe eines einzigartigen Kippmechanismus funktionieren. Das Magazin-Cover wurde von Oliver Hoeller entworfen: www.oliverhoeller.com.
Bakterien sind allgegenwärtig. Sie finden sich in der Luft, im Boden, im Wasser, im menschlichen Körper und auf der Haut. Einige Bakterien dienen als Grundlage für Produkte, die das Leben der Menschen verbessern. Aufgrund ihres schnellen Wachstums und der vergleichsweise leichten Manipulierbarkeit gelten Bakterien als die „Arbeitspferde“ in den Bereichen Molekularbiologie, Genetik und Biochemie.
Wie alle anderen Organismen sind auch Bakterien auf geringe Mengen organischer Verbindungen in ihrer Nahrung angewiesen. „Viele Bakterien können jedoch keine essenziellen Vitamine synthetisieren und müssen sie daher aus ihrer Umgebung aufnehmen“, erklärt Tidow. Diese Aufgabe wird von sogenannten „Energy-coupling factor (ECF)“-Transportern übernommen. Sie gehören zu einer Familie integraler Membranproteine, von denen angenommen wird, dass sie über einen einzigartigen Kippmechanismus funktionieren. In ihrem Forschungsprojekt konzentrierten sich die Wissenschaftler auf eine der zwei Untergruppen, in die sich die Familie aufteilt: die weniger bekannte Gruppe I der ECF-Transporter besteht aus einem spezifischen Gerüstprotein (T) und einem Substratbindeprotein (S). „Die S- und T-Komponenten waren uns bekannt, aber die molekularen Details ihrer Interaktionen und Strukturen waren bislang unbekannt“, sagt CUI-Postdoc Inokentijs Josts, der Erstautor der Studie.
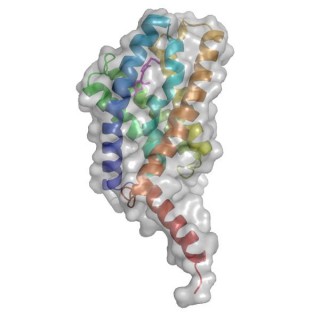
Struktur eines YkoE Proteins mit gebundenem Thiamin. Foto: Henning Tidow, Universität Hamburg
Mit Hilfe von lipidic-cubic phase Röntgenkristallographie, ergänzt durch Moleküldynamik-Simulationen und Fluoreszenzspektroskopie, bestimmten die Wissenschaftler die Struktur eines Thiamin-gebundenen Substratbindeproteins (YkoE) in einer lipidreichen Umgebung. Diese Strukturanalyse offenbarte essenzielle Unterschiede zwischen YkoE und den besser bestimmten ECF-S-Komponenten der Gruppe II. Dadurch wurde deutlich, wie S-Komponenten der Gruppe I sich von anderen ECF-Transportern der Gruppe I und II unterscheiden.
Tidow: „Wir konnten die Kristallstruktur bestimmen und dadurch wichtige Erkenntnisse über die Funktionsweise und die Interaktion zwischen S- und T-Komponenten gewinnen. Das wird uns helfen, die Transportmechanismen und die Dynamik dieser einzigartigen Transporter-Familie zu entschlüsseln, die in vielen pathogenen Bakterien vorkommt und daher ein potentielles Ziel für die Entwicklung von Antibiotika darstellt.“
Originalpublikation:
Josts I., Hernandez A., Andreeva A., Tidow H.
“Crystal structure of a group I ECF vitamin transporter S-component in complex with its cognate substrate”
Cell CHemical Biology (23) 7, 827–836 (2016)
DOI:10.1016/j.chembiol.2016.06.008

