Strukturdynamik mit atomarer Auflösung: Der Traum vieler Experimentatoren ist es, die Bewegung der Atome bei chemischen Prozessen wie dem Aufbrechen einer Bindung direkt zu beobachten. Die Entwicklung extrem brillanter Elektronen- und Röntgenstrahlungsquellen machen solche Untersuchungen mittlerweile möglich.
Kohärente Bildgebungsverfahren erlauben nun die direkte Beobachtung atomarer Bewegungen in komplexen Systemen, wie sie zum Beispiel bei biologischen Reaktionen oder in Form kollektiver Moden in Systemen der kondensierten Materie auftreten. Im Forschungsfeld B verbinden wir in einem interdisziplinären Ansatz die Expertisen der Bereiche Laserwissenschaft, Strukturbiologie, Chemie, molekulare Physik und der Streuexperimente und konzentrieren uns auf die grundlegenden Konzepte, welche das Verhalten von Systemen erklären. Anwendungsbeispiele umfassen kleine Moleküle bis hin zu Aminosäuren und Proteinkomplexen.
Forschungsschwerpunkt B.1: Struktur-Funktions-Korrelationen in biologischen Systemen
Der Forschungsschwerpunkt umfasst drei integrierte Forschungsprojekte:
- B1.1: Atomar aufgelöste Reaktionsdynamik von Modellsystemen
- B1.2: Atomistische Perspektive auf biologische Funktion
- B1.3: Organisation auf großen Längenskalen
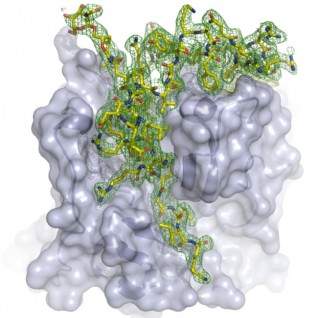
Durch den Superröntgenlaser LCLS sichtbar gemachte molekulare Struktur.
Aus wissenschaftlicher Sicht ist die Natur aus fundamentalen Bauelementen mit verschieden ausgeprägter Komplexität aufgebaut. Sie umfasst Atome und einfache Moleküle und reicht bis hin zu selbstorganisierten Strukturen. Im Bereich B1 versuchen wir Struktur-Funktionskorrelationen zu verstehen, indem wir kleine wohl-definierte und wohl-kontrollierte Systeme untersuchen. Hierbei gehen wir von kleinen Molekülen in der Gasphase über Aminosäuren und größere biomolekulare Systeme wie Proteine bis hin zu Proteinkomplexen.
Ein Ziel besteht darin, die Bedeutung und den Einfluss der Dynamik auf die Struktur-Funktionsbeziehung für Proteine zu ergründen. Die Möglichkeit, den Übergangszustand bei chemischen Reaktionen direkt zu beobachten, ist der ‚Heiligen Gral‘ der physikalischen Chemie. Die Umsetzung verbindet Biologie und Chemie auf der molekularen Ebene. Eines unserer weiteren Ziele ist die direkte Beobachtung grundlegender biologischer Prozesse in lebenden Zellen mit einer Auflösung im Nanometer- und Nanosekundenbereich.
Um unsere Ziele zu verwirklichen, verwenden wir ultraschnelle und extrem brillante XFEL- und Elektronenquellen der nächsten Generation sowie fortgeschrittene Techniken der molekularen Spektroskopie. Begleitend kommen neuartige Herangehensweisen bei der Präparation und Behandlung von Proben zum Einsatz.
Forschungsschwerpunkt B.2: Erweiterung der strukturellen Basis der Biologie mit neuartigen Strahlungsquellen
Die in Hamburg zur Verfügung stehenden Methoden der Strukturbiologie ermöglichen die Vermessung des dreidimensionalen atomaren Aufbaus einer Vielzahl biologischer Makromoleküle. Diese kann einzelne Bereiche eines Proteins betreffen und sogar Komplexe aus mehreren Proteinen, molekulare Maschinen und Membranproteine umfassen.
Ein Forschungsprojekt im CUI konzentriert sich auf die detaillierte Untersuchung einer zentralen injektionsnadelförmigen Nanomaschine, des Typ-III-Sekretionssystems (TTSS), die in zahlreichen bakteriellen Krankheitserregern zu finden ist. Diese makromolekularen Maschinen sind in der Lage, ein ganzes Arsenal spezieller bakterieller Giftstoffe zu translozieren, von denen manche den Stoffwechselmechanismus der Wirtszelle zum Nutzen der Krankheitserreger verändern. Der Zusammenbau, die Penetration der Wirtszellmembran und die Aktivierung von Transportkanälen sind bei weitem noch nicht verstanden. Die Visualisierung der Dynamik, wie solche Prozesse auf der molekularen Ebene stattfinden, bedeutet einen Quantensprung für die Infektionsbiologie.
Des Weiteren werden Strukturen zu verschiedenen Zeitpunkten bestimmt, um photostimulierte ATP/GTP-getriebene Reaktionen zeitaufgelöst über mehrere Zeitskalen verfolgen zu können. Hierbei kommen neuartige Strahlungsquellen zum Einsatz, die am DESY bereits vorhanden oder im Aufbau begriffen sind. Als Folge hieraus tun sich neue Möglichkeiten auf, molekulare Maschinen in Aktion beobachten zu können.
Eine weitere Herausforderung stellen Proteine und Proteinkomplexe dar, die gegenwärtig aufgrund der begrenzten Anwendbarkeit der vorhandenen Standardmethoden noch nicht untersucht werden können. Nur 15% der löslichen Proteine bilden Kristalle, die für eine herkömmliche Kristallographie groß genug sind. Die Situation ist weitaus schlechter für Proteine, die in biologischen Membranen eine Rolle spielen. Bestimmte Membranproteine spielen eine zentrale Rolle beim Transport von Medikamenten durch die Zellmembran und sind daher für medizinische Anwendungen von herausgehobener Bedeutung. Mehr als 30% der menschlichen Gene kodieren Membranproteine und die Wirkung von etwa 60% aller Medikamente beruht auf deren Wechselspiel mit Membranproteinen.
Neuartige ultraintensive Röntgen- und Elektronenquellen eröffnen daher völlig neue Möglichkeiten jenseits der bisher geglaubten Begrenzungen hinsichtlich der molekularen Größe, Komplexität und Dynamik, um der Struktur-Funktionsbeziehung in biologischen Systemen auf die Spur zu kommen.
Forschungsschwerpunkt B.3: Neue Methoden der Bildgebung mit atomarer Auflösung
Die am CUI beteiligten Wissenschaftler arbeiten mit theoretischen und experimentellen Methoden und stammen aus so unterschiedlichen Disziplinen wie Informatik, Streuphysik, Struktur- und Systembiologie. Weitere Tätigkeitsfelder betreffen die Handhabe von Proben sowie die Entwicklung von Laser-, Röntgen- und Elektronenquellen. In diesem interdisziplinären Rahmen werden die Expertisen auf diesen Gebieten verbunden, um die Struktur und Dynamik auf molekularer Ebene jenseits des bisher Möglichen zu betrachten.

Detail des Beugungsbildes eines Nanokristalls.
Die einzigartigen Strahlungsquellen in Hamburg sowie die hervorragende Ausstattung und weitreichenden Entwicklungsmöglichkeiten des Clusters bieten ein außergewöhnliches Umfeld, um neue Erkenntnisse über den Aufbau und die Dynamik biologischer Moleküle und molekularer Strukturen zu gewinnen. Chemische und biologische Prozesse analysieren wir auf der atomistischen Ebene und beobachten sie bis hin zum Femtosekundenbereich. Unsere Gruppen untersuchen kinetische Phänomene, molekulare Erkennungsprozesse, die Bewegung begrenzter Bereiche von Molekülen sowie Stufen der Proteinfaltung, Umfaltungsprozesse und Aggregationsverhalten. Zum Einsatz kommen hier der Freie-Elektronen-Laser FLASH, die hoch-brillante Synchrotronstrahlung von PETRA III und zukünftig der europäische Röntgenlicht-Freie-Elektronen-Laser XFEL. Diese Untersuchungen werden von der einzigartigen Verbindung von extrem kohärenten und intensiven Strahlungsquellen mit neuartigen Bildgebungsverfahren umfangreich profitieren.
Die neue Technik der seriellen Femtosekunden-Kristallographie in Verbindung mit Methoden, Beugungsdaten aufeinander abzustimmen, ebnet uns den Weg zur Beobachtung immer kleinerer Proben und macht Nanokristalle und letztendlich nicht-kristallisierte molekulare Systeme zugänglich. Um diesen Fortschritt Wirklichkeit werden zu lassen, wird die kohärente Streuung als experimentelle Technik weiterentwickelt und mit der theoretischen Modellierung verbunden. Wir etablieren neue fortgeschrittene Methoden zur Präparation zweidimensionaler molekularer Kristalle bzw. nanokristalliner Suspensionen für Röntgen- und Elektronbeugungsexperimente. Mit Hilfe der in vivo Kristallisation können Myriaden von Nanokristallen für XFEL- oder Elektronenbeugungsexperimente hergestellt werden. Diese Methode ist ausschlaggebend dafür, dass CUI-Wissenschaftler erstmals makromolekulare Strukturen an einem Röntgenlicht-Freie-Elektronen-Laser aufklären konnten. Wir entwickeln diesen Ansatz in eine halbautomatisierte Kristallisationsplattform weiter und verbinden ihn mit Methoden, die eine genaue Überwachung des Kristallwachstums und die Optimierung der Herstellung von kristallinen Teilchen erlauben, die nicht im Lichtmikroskop beobachtet werden können.
Beteiligte Forschungsgruppen
- Prof. M. Aepfelbacher
- Prof. C. Betzel
- Prof. R. Blick
- Prof. C. Bressler
- Prof. H. Chapman
- Prof. G. Grübel
- Prof. F. Kärtner
- Prof. J. Küpper
- Prof. R.J.D. Miller
- Prof. C. Morrison
- Prof. A. Pearson
- Prof. A. Rentmeister
- Prof. R. Santra
- Dr. M. Schnell
- Prof. M. Thorwart
- Prof. Henning Tidow
- Dr. T. Tschentscher
- Prof. E. Weckert
- Prof. H. Weller
- Dr. M. Wilmanns
- Prof. B. Ziaja-Motyka

