Eine neue Art der Kristallographie wird Wissenschaftlerinnen und Wissenschaftlern gänzlich neue Möglichkeiten bieten, die Bewegungen von Molekülen zu beobachten. Im Fachmagazin Nature Methods beschreibt ein Forscherteam unter der Leitung von Prof. Arwen Pearson ein neues Verfahren der zeitaufgelösten Kristallographie – einer Methode zur Beobachtung von Strukturänderungen in Molekülen, die es einer deutlich größeren Zahl von Wissenschaftlerinnen und Wissenschaftlern als bisher erlauben wird, Proteindynamik zu analysieren. Diese Grundlagenforschung ist eine Voraussetzung für die Entwicklung neuer Medikamente und neuartiger Materialien.
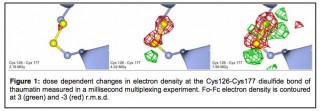
Die Illustration auf Basis der neuen Methode zeigt, wie eine Disulfidbrücke Schritt für Schritt aufbricht. Bild: Arwen Pearson
Die bisherigen Methoden der ultraschnellen Kristallographie (Laue Kristallographie) erfordern speziell ausgelegte Synchrotron-Strahlungsquellen, die es nur an drei Orten der Welt gibt – ein wesentlicher Grund, warum bis heute lediglich eine Hand voll Proteine zeitaufgelöst analysiert ist. Die neue Methode bietet Wissenschaftlerteams weltweit Zugang zur dynamischen Kristallographie und wird Forschungsbereiche, die sich mit der Analyse von Molekülen befassen, maßgeblich vorantreiben. Entwickelt wurde die Methode an der University of Leeds; seit Mai 2014 ist Arwen Pearson Professorin am CUI. „Es ist, als würden wir einen Film für Kristallographen drehen“, sagt die Wissenschaftlerin. „Die Natur bewegt sich. Und um sie zu verstehen, müssen wir in der Lage sein, die Bewegungen biologischer Strukturen auf atomarer Ebene zu beobachten. Genau das ermöglicht dieser Durchbruch an konventiellen Strahlungsquellen.“
Bei der traditionellen Kristallographie werden Röntgenstrahlen auf kristallisierte Moleküle geschossen. Dabei entsteht ein Beugungsbild, mit dessen Hilfe die atomare Struktur des Moleküls berechnet werden kann. Eine wesentliche Einschränkung besteht jedoch darin, dass das Beugungsbild den Durchschnitt aller Moleküle und ihrer Bewegungen in einem Kristall während der Zeitdauer des Experiments abbildet.
Dr. Briony Yorke, führende Wissenschaftlerin des Projektes und mittlerweile Postdoc in Hamburg, erklärt: „Ein statisches Bild reicht nicht aus, wenn man herausfinden möchte, wie molekulare Strukturen arbeiten. Das ist als wollte man herausfinden, wie ein Auto funktioniert, ohne aber den Motor zu starten. Man kann sich die Zündkerzen und die Kolben ansehen und Vermutungen über die Funktionsweise anstellen. Aber um es wirklich zu verstehen, muss man es in Bewegung zu sehen.“
Ein bewegtes Bild entsteht
Der bisherige Lösungsansatz lässt sich mit dem mühsamen Dreh-Prozess eines animierten Films vergleichen: Die Wissenschaftlerinnen und Wissenschaftler bringen einen Satz Moleküle in einen identischen Zustand und regen sie an (pump). Nach einer definierten Zeit erstellen sie einen kristallographischen Schnappschuss der Struktur und wiederholen das Experiment: Synchronisieren der Moleküle, Pumpen, Schnappschuss zu einem etwas späteren Zeitpunkt im Prozess. Langsam entsteht so ein bewegtes Bild.
Dieser sogenannte Pump-Probe-Ansatz wurde in den 1940er Jahren erstmals vorgestellt; 1967 erhielt der britische Chemiker George Porter den Nobelpreis für seine Methode, die die Beobachtung von ultraschnellen dynamischen Prozessen erst ermöglichte. Eine wesentliche Einschränkung des Pump-Probe-Ansatzes für die Kristallographie ist, dass die Schnappschüsse nur für einen sehr kurzen Moment sichtbar gemacht werden können (weniger als der 100 millionste Teil einer Sekunde), um die Molekular-Bewegung einzufangen. Das wiederum bedeutet, dass nur ein außerordentlich kurzer Moment zur Verfügung steht, um mit Hilfe des Lichtpulses ein kristallographisches Bild zu erzeugen. Derzeit stellen weltweit nur drei Synchrotrons – in den USA, in Frankreich und in Japan -, Strahlführungen mit der hierfür benötigten Auslegung zur Verfügung.
Der neue Ansatz nutzt die mathematische Methode der Hadamard Transformation und öffnet damit das Feld für wesentlich weniger starke Strahlungsquellen. Wie in Porters Methode werden die Moleküle synchronisiert und angeregt. Dann jedoch nutzte das Team um Arwen Pearson eine bestimmte Form von Lichtpulsen. Diese Pulse erzeugen ein einzelnes kristallographisches Bild – wie ein sehr lang belichtetes Foto. Danach wiederholten die Wissenschaftler das Experiment, indem sie eine etwas andere Form von Lichtpulsen nutzen, und erzeugten ein weiteres „lang belichtetes Foto“. Dieser Prozess wurde mit allen Formen von Lichtpulsen wiederholt, die sich aus der mathematischen Formel ergeben.
Erfolg trotz unscharfer Bilder
Zwar ist jedes einzelne aus den Lichtpuls-Formen entstandene „lang belichtete Foto“ unscharf; aus den Unterschieden der einzelnen Bilder und der Lichtpuls-Formen können die Wissenschaftlerinnen jedoch einen Film über die sich verändernden Strukturen der Moleküle gewinnen.
„Das Wunderbare an der Methode ist, dass wir keine scharfen Snapshots benötigen, und damit auch nicht das sehr starke Licht von Porters Methode. Dies ist ein gänzlich neuer Weg, ein zeitaufgelöstes Experiment durchzuführen, der viele der heutigen Hindernisse umgeht“, sagt Arwen Pearson.
Originalveröffentlichung:
Yorke, Beddard, Owen, and Pearson
“Time-resolved crystallography using the Hadamard Transform”
Nature Methods (2014)
DOI: 10.1038/nmeth.3139
Kontakt:
Prof. Arwen Pearson
The Hamburg Centre for Ultrafast Imaging (CUI)
Arwen.pearson@cfel.de
040/8998-6650
Dr. Briony Yorke
The Hamburg Centre for Ultrafast Imaging (CUI)
Briony.yorke@cfel.de
040/8998-6655

