Mit einer speziellen Hochgeschwindigkeits-Röntgenkamera hat ein internationales Forscherteam die ultraschnelle Reaktion eines Proteins auf Licht beobachtet. Die im US-Fachjournal „Science“ veröffentlichte Studie zeigt lichtgesteuerte Atombewegungen, die nur 100 billiardstel Sekunden (100 Femtosekunden) dauern. Die verwendete Untersuchungstechnik kann Einblicke in die Dynamik einer Vielzahl lichtempfindlicher Biomoleküle ermöglichen, die an zentralen biologischen Prozessen wie der Photosynthese oder dem Sehen beteiligt sind.
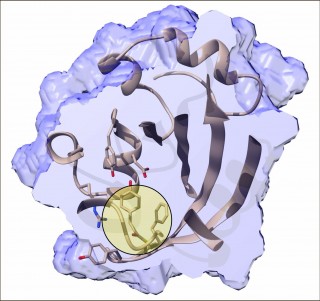
Innere Struktur des photoaktiven Proteins PYP rund 800 Femtosekunden nachdem die Trans-zu-Cis-Isomerisierung durch einen ultrakurzen blauen Laserblitz ausgelöst wurde. Der lichtempfindliche Chromophor ist durch den Kreis hervorgehoben. Foto: Marius Schmidt/Universität von Wisconsin, Milwaukee
Das Team um Prof. Marius Schmidt von der Universität von Wisconsin in Milwaukee nutzte für seine Untersuchungen den Röntgenlaser LCLS am US-Forschungszentrum SLAC in Kalifornien. Mit den hellen Röntgenblitzen untersuchten die Forscher den lichtempfindlichen Teil des photoaktiven gelben Proteins PYP (photoactive yellow protein). Es hilft bestimmten Bakterien, blaues Licht zu erkennen, damit sie sich von zu energiereichem Licht fernhalten können.
Für ihre Untersuchungen schleusten die Wissenschaftler die lichtempfindlichen Proteine in eine Reaktionskammer, wo sie von einem optischen blauen Laserblitz aktiviert wurden. Einen kurzen Moment später folgte ein Röntgenlaserblitz, mit dem sich die räumliche Struktur des Proteins auf einzelne Atome genau untersuchen lässt. Indem sie den zeitlichen Abstand der beiden Blitze systematisch variierten, konnten die Forscher analysieren, wie das aktivierte Protein mit der Zeit seine Gestalt verändert. „In der richtigen Ordnung – entsprechend der Zeitverzögerung zwischen optischem und Röntgenlaserblitz – ergeben die Schnappschüsse eine Art Film der Protein-Reaktion vom ersten, 100 Femtosekunden langen Schritt bis zu mehreren tausend Femtosekunden“, erläutert Erstautorin Dr. Kanupriya Pande von der Universität von Wisconsin, die inzwischen ans Center for Free-Electron Laser Science gewechselt ist.
„Die Absorption von Licht versetzt PYP in einen angeregten Zustand, den es jedoch schnell wieder verlässt“, sagt Forschungsleiter Schmidt. „Das tut es, indem es seine atomare Struktur über eine sogenannte Trans-zu-Cis-Isomerisierung neu ordnet. Wir sind die ersten, denen es gelungen ist, Echtzeit-Schnappschüsse von dieser Sorte Reaktion aufzunehmen.“ Diese Art von Isomerisierung findet auch beim Sehen im Auge statt, wo der Chromophor in der Netzhaut eine Trans-zu-Cis-Isomerisierung vollführt, die schließlich ein Nervensignal im Auge auslöst.
„Mit den Aufnahmen am weltstärksten Röntgenlaser konnten wir detaillierte Bilder der Proteinstruktur unfassbar schnell nach der ursprünglichen Licht-Absorption gewinnen“, betont Ko-Autor und CUI-Mitglied Prof. Henry Chapman (Universität Hamburg, DESY, CFEL). „Allerdings waren diese Experimente eine große Herausforderung“, berichtet Pande. „Wir benötigten einige Innovationen, um den hunderttausenden Röntgenbildern den korrekten Zeitstempel zuzuweisen.“
Die Forscher hatten bereits in einer früheren Studie lichtgesteuerte Strukturänderungen bei PYP untersucht. Dabei konnten sie Atombewegungen von zehn milliardstel Sekunden (10 Nanosekunden) Dauer beobachten. Durch verschiedene Verbesserungen ihres Experiments unter anderem mit einem schnelleren optischen Laser sowie besseren Zeitmess- und Sortierwerkzeugen haben sie ihre „Geschwindigkeitsbegrenzung“ jetzt auf rund das Hunderttausendfache erhöht. Auf diese Weise konnten sie Proteinreaktionen beobachten, die tausendmal schneller sind als alle, die bislang in Röntgenexperimenten aufgezeichnet wurden.
„Die neuen Daten zeigen erstmals, wie der Bakteriensensor unmittelbar nach der Lichtabsorption reagiert“, unterstreicht Ko-Autor Dr. Andy Aquila von SLAC. „Die erste Reaktion, die quasi sofort stattfindet, ist von zentraler Bedeutung, da sie eine Art Welleneffekt im Protein in Gang setzt, der den Weg für die biologische Funktion bereitet.“
Die Technik könnte sich als nützlich erweisen, um auch eine Reihe anderer ultraschneller lichtgesteuerter Prozesse zu enträtseln. Beispielsweise wie Sehpigmente im Auge auf Licht reagieren und wie zu viel Licht ihnen schaden kann. Oder wie Organismen mit Hilfe der Photosynthese Licht in chemische Energie verwandeln, was als Modellprozess für neue Energietechnologien dienen könnte. Oder wie Atomstrukturen auf Lichtpulse unterschiedlicher Form und Länge reagieren, was ein wichtiger erster Schritt zur Kontrolle chemischer Reaktionen durch Licht wäre.
Zusätzlich zur Universität von Wisconsin in Milwaukee, SLAC, DESY und der Universität Hamburg waren an der Studie das Imperial College London, die Universität Jyväskyla in Finnland, die Arizona State University, das Hamburger Max-Planck-Institut für Struktur und Dynamik der Materie, die State University of New York in Buffalo, die Universität Chicago und das Lawrence Livermore National Laboratory beteiligt.
Originalveröffentlichung:
Pande K. et al.
„Femtosecond structural dynamics drives the trans/cis isomerization in photoactive yellow protein„
„Science”, 2016
DOI: 10.1126/science.aad5081

