Ein internationales Forscherteam unter der Leitung von CUI-Mitglied Prof. Henning Tidow von der Universität Hamburg hat eine neue Methode zur Untersuchung von Membranproteinen entwickelt. Dabei nutzte das Team die besondere Eigenschaft eines Wasserstoff-Isotops: Deuterium-markierte ‚stealth carrier‘ Nanodiscs (sND) können für Neutronenstrahlung unsichtbar gemacht werden, so dass die Struktur integrierter Membranproteine ohne störende Effekte untersucht werden kann. Die Forscher berichten in der jüngsten Ausgabe des Journals „Structure“ über ihre Ergebnisse.
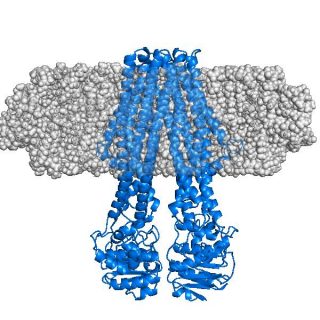
Das Konzept von ‘stealth carrier’ Nanodiscs: Das integrale Membranprotein (blau) ist in eine semi-transparente graue Sphäre eingebettet, die in SANS-Experimenten mit Neutronenstrahlen unsichtbar bleibt. Illustration: Tidow, Universität Hamburg
Integrale Membranproteine (IMP) spielen eine zentrale Rolle im Leben einer Zelle: Sie sind die Grundlage für den Transport von Materie und Signalen durch die Zellmembran und stellen somit einen wesentlichen Ansatzpunkt für die Entwicklung von Medikamenten dar. Dabei ist es von großer Bedeutung, detaillierte Kenntnisse über die Struktur und die Dynamik unterschiedlicher Zustände zu gewinnen. Das Problem ist jedoch, dass sehr viele Membranproteine außerhalb einer Lipid-Umgebung sowohl an Stabilität als auch an Aktivität und Funktion verlieren, so dass es sehr schwierig ist, ihre Struktur zu analysieren.
Ein Werkzeug zur Lösung des Problems sind Nanodiscs aus Lipiddoppelschicht-Gerüsten. Sie ermöglichen die Untersuchung integraler Membranproteine in einer Lipid-Umgebung, die der ursprünglichen Lösungsumgebung entspricht. Tidow: „Mit Hilfe von Kleinwinkelsteuung lassen sich gesamte IMP/Nanodics-Systeme sehr gut darstellen. Aufgrund des komplexen Zusammenspiels des Streusignals der unterschiedlichen Nanodisc-Komponenten bleibt die Daten– und Strukturanalyse des eingebundenen IMP jedoch eine besondere Herausforderung.“
Tidow und sein Team setzten jetzt sND-Technologie ein, um ein Membranprotein – den ABC-Transporter MsbA – in ‚stealth carrier‘ Nanodiscs einzubinden. Durch die effektive Unsichtbarkeit dieses Trägersystems konnten sie mittels Neutronenkleinwinkelstreuung (SANS) qualitativ hochwertige SANS-Daten des Membranproteins in einer lipiden Umgebung erlangen.
So ist es den Forschern gelungen, Strukturmodelle verschiedener konformationeller Zustände des MsbA-Proteins in Lösung zu entwickeln. Die Methode lässt sich auf andere Gruppen integraler Membranproteine übertragen und ebnet den Weg zu einer niedrigauflösenden Strukturbestimmung von integralen Membranproteinen in Lösungen.
An der Arbeit waren Forscherinnen und Forscher der Universität Hamburg, des EMBL in Hamburg, der Universität Malmö, des ILL Grenoble und des MLZ München beteiligt. Text: CUI
Originalveröffentlichung:
Josts I. et al.
„Conformational states of ABC transporter MsbA in a lipid environment investigated by small-angle scattering using stealth carrier nanodiscs“
Structure 26, 8 (2018)
DOI: 10.1016/j.str.2018.05.007

